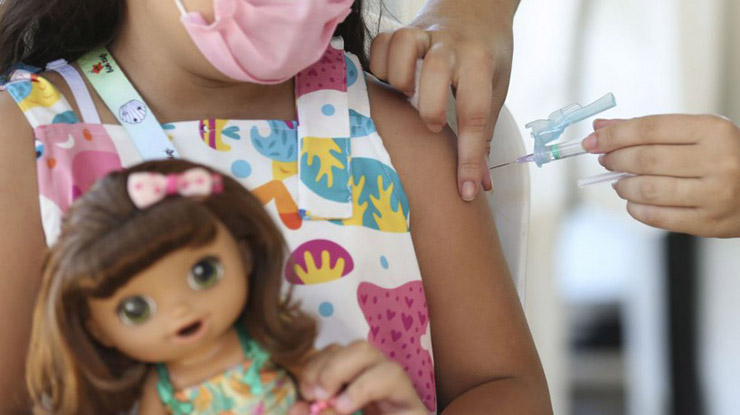
A Ufes está informando que a Agência Nacional de Vigilância Sanitária (Anvisa), ao aprovar nesta semana o uso emergencial da vacina CoronaVac para crianças na faixa etária de 3 a 5 anos de idade usou estudos de fontes diversas. Dentre esses estudos científicos que contribuíram para a construção das evidências científicas sobre o uso da Coronavac está o Projeto Curumim, realizado por pesquisadores do Hospital Universitário Cassiano Antônio Moraes (Hucam-Ufes/Ebserh) com apoio da Fiocruz/Instituto René Rachou, do Instituto Butantan e da Secretaria de Saúde do Estado do Espírito Santo (Sesa).
Na reunião da Anvisa, a coordenadora do Curumim, a professora e médica Valéria Valim, apresentou os dados preliminares do estudo, que tem o objetivo de verificar a eficácia, a segurança e a produção de anticorpos (proteínas de defesa) e células de defesa nas crianças e adolescentes após a administração de duas doses da vacina Coronavac, além de comparar esses indicadores com os produzidos pela vacina da Pfizer.
“Os estudos clínicos do Chile [utilizados como referência pela Anvisa] trouxeram dados muito relevantes de segurança. Nossos dados locais corroboram a segurança e mostram boa resposta imunológica. A nossa pesquisa foi a única no Brasil que analisou essa faixa etária (3 a 4 anos)”, afirmou Valim. O Projeto Curumim envolveu 1.125 crianças, sendo 460 no grupo randomizado, com aplicação de doses de Coronavac e Pfizer, na faixa etária de 5 a 17 anos; e 665 no grupo não randomizado, incluindo crianças de 3 e 4 anos de idade, que só receberam Coronavac.
Segundo Valim, o resultado principal obtido até a fase atual do projeto foi uma frequência no desenvolvimento de anticorpos anti-RBD (Receptor Binding Domain) da proteína Spike (IgG-S) 28 dias após a aplicação da segunda dose da vacina. Também como desfechos do estudo, a médica apontou a segurança da vacina, não sendo registrado nenhum efeito adverso moderado ou grave em 90 dias, a resposta imune humoral e a resposta imune celular. A conclusão é que a Coronavac em crianças de 3 e 4 anos é segura, capaz de induzir títulos maiores de anticorpos quando em comparação ao que ocorre em crianças com 5 anos ou mais, adolescentes e adultos.
O estudo também mostrou que a Coronavac é menos reatogênica que a Pfizer em crianças. Não houve eventos adversos graves, internações ou mortes com uso de nenhum dos imunizantes em todas as faixas etárias pesquisadas.
Próximas fases do Projeto Curumim
As próximas fases do Projeto Curumim são: análise de segurança e de imunidade humoral (IgG-S antiRBD), que prossegue até o final de julho; análise de PRNT (teste de neutralização), análise de eficácia e de imunidade celular luminex, até setembro; análise de variantes (PRNT); análise por comorbidades e imunidade celular imunofenotipagem, até dezembro; e análise de duração da imunidade humoral e celular, até março de 2023.
Como a Anvisa analisou o pedido do Butantan
Para esta análise, a Anvisa fez uma busca ativa por informações que permitissem verificar com clareza o benefício da vacina para a faixa etária de 3 a 5 anos, inclusive com informações conhecidas como “dados de vida real”, ou seja, de resultados em populações já vacinadas. A agência analisou os seguintes dados:
1) Instituto Butantan: dados submetidos pelo Instituto Butantan e que deram início ao processo de análise.
2) Relatório do Estudo – Projeto Curumim que avaliou a eficácia, segurança e imunogenicidade da vacina inativada (CoronaVac) para Covid-19 em crianças e adolescentes.
3) Relatório do Estudo Immunita, do Instituto René Rachou, Fiocruz Minas, um estudo transversal de imunogenicidade, efetividade e reatogenicidade da vacina Coronavac.
4) Dados do Programa Vigivac, da Fiocruz Bahia, que é um programa de efetividade das vacinas anti-Covid-19 no Brasil.
5) Dados de vacinação no Chile: a Anvisa contou com dados enviados por pesquisadores no Chile que acompanham a vacinação de crianças com a CoronaVac naquele país.
6) Pareceres de especialistas externos: para a avaliação a Anvisa contou com os pareceres de especialistas externos convidados para auxiliar a Anvisa na avaliação da vacina. Os especialistas tiveram acesso aos dados de técnicos e de pesquisa da vacina. Participaram desta atividade Sociedade Brasileira de Pediatria (SBP), Sociedade Brasileira de Infectologia (SBI), Sociedade Brasileira de Pneumologia e Tisiologia (SBPT), Sociedade Brasileira de Imunizações (SBIm) e Associação Brasileira de Saúde Coletiva (Abrasco).
7) Dados de literatura científica publicados.
Histórico da vacina CoronaVac no Brasil
A vacina CoronaVac está autorizada para uso emergencial no Brasil desde o dia 17 de janeiro de 2021. Em 20 de janeiro de 2022 a Anvisa autorizou a ampliação do uso da vacina para crianças e adolescentes de 6 a 17 anos de idade. Em 14 de março de 2022 o Instituto Butantan solicitou a ampliação do uso para crianças de 3 a 5 anos. Em 8 de abril o Instituto Butantan solicitou a inclusão da previsão de dose de reforço para CoronaVac. Este pedido está em análise e depende da apresentação de dados e informações complementares. Em 9 de julho de 2022 o Instituto Butantan fez a solicitação do registro definitivo para CoronaVac. O pedido está em análise pela equipe técnica.
A Anvisa lembra que as vacinas contra Covid-19 autorizadas no Brasil para crianças são: Pfizer, a partir de 5 anos, e a vacina CoronaVac, a partir de 6 anos. A decisão da última quinta-feira (14) autorizou a ampliação do uso da vacina CoronaVac para a imunização de crianças a partir de 3 anos de idade.
